1.はじめに
近年、医療の現場だけでなく、その前段階である「創薬」のプロセスにおいても、AI(人工知能)技術が目覚ましい進化を遂げています。
かつては数年を要していた標的タンパク質の構造解析や、有効成分の探索(スクリーニング)が、AIによって劇的に短縮されつつあります。特に注目を集めているのが、Google DeepMindが発表した「AlphaFold3」と、MIT(マサチューセッツ工科大学)発の技術である「Boltz-2」です。
本記事では、これら2つの最先端AIモデルの特徴を比較し、それらがどのように連携して新薬開発を加速させているのか、医療関係者の皆様に向けて分かりやすく解説します。
2.構造生物学の巨人:AlphaFold3の革新と限界
2.1. 生体分子の「形」を予測する圧倒的な能力
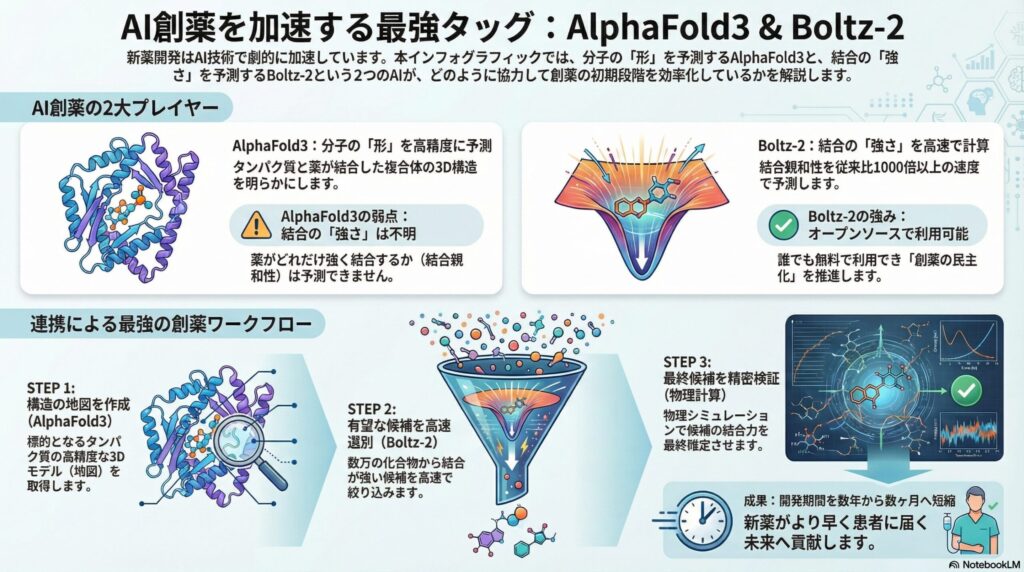
2024年にGoogle DeepMindとIsomorphic Labsが発表した「AlphaFold3(アルファフォールド3)」は、創薬研究に衝撃を与えました。その最大の特徴は、タンパク質単体だけでなく、DNA、RNA、低分子化合物(リガンド)、糖鎖など、生体内のあらゆる分子が結合した「複合体」の構造を高精度に予測できる点です。
従来、薬が作用するポケット(結合部位)の形状を特定するには、X線結晶構造解析などの高コストな実験が必要でした。AlphaFold3は、拡散モデル(Diffusion Model)という画像生成AIに近い技術を用いることで、これらの実験データがない新規の標的タンパク質であっても、非常に高い精度でその3次元構造を予測します。
Nature誌に掲載されたデータによれば、従来のドッキングツール(薬とタンパク質の結合をシミュレーションするソフト)と比較しても、その構造予測の精度は統計的にも圧倒的です。これは、未知のウイルスや、これまで創薬が難しかった標的に対する薬剤設計の第一歩を、劇的に早めることを意味します。
2.2.「形」は分かるが「強さ」は分からない?
しかし、AlphaFold3には創薬において致命的とも言える弱点があります。それは、「結合親和性(Binding Affinity)」を予測できないことです。
結合親和性とは、薬が標的タンパク質に「どれくらい強く結合するか」を示す指標です。AlphaFold3は、「薬がここにハマるかもしれない」という「形」を見せるのは得意ですが、「その結合が強いか弱いか」を判断する機能を持っていません。
また、AIがもっともらしい嘘をつく「ハルシネーション(幻覚)」の問題も残っています。物理的にはあり得ない原子の重なりや、実際には存在しない構造を描画してしまうことがあり、専門家による慎重なチェックが依然として必要です。
3.新星の登場:結合親和性を予測するBoltz-2
3.1. 構造だけでなく「効き目の強さ」を数値化する
AlphaFold3の課題に対し、2025年にMITとRecursionの研究者たちが発表したのが「Boltz-2(ボルツ2)」です。このモデルの画期的な点は、タンパク質と薬剤の3次元構造を予測するだけでなく、その「結合親和性」までも同時に予測できる点にあります。
新薬候補となる化合物は、何万、何億という膨大なライブラリの中に存在します。それらの中から有望なものを選び出すには、単に「形が合う」だけでなく、「強く結合して離れない(=薬効が高い可能性がある)」ものを見極める必要があります。
Boltz-2は、FEP(自由エネルギー摂動法)と呼ばれる、物理学的に厳密だが計算に膨大な時間がかかる従来の手法と比較して、約1000倍以上の速度で結合の強さを計算できます。具体的には、従来の手法で1つの化合物を評価するのに数時間かかっていた計算を、わずか20秒程度で完了させるのです。
3.2. オープンソースがもたらす「創薬の民主化」
Boltz-2のもう一つの大きな功績は、MITライセンスの下で完全に「オープンソース」化されている点です。つまり、世界中の研究者や企業が無料でこの技術を利用でき、自社の研究に合わせて改良することも可能です。
AlphaFold3は一部の機能利用に制限があるクローズドな側面がありますが、Boltz-2は誰にでも開かれています。これにより、資金力のある巨大製薬企業だけでなく、大学の研究室やベンチャー企業でも、最先端のAIを使った創薬が可能になり、まさに「創薬プロセスの民主化」を推進しています。
4.AlphaFold3 vs Boltz-2:適材適所の使い分け
4.1. それぞれの得意分野(ドメイン)を理解する
これら2つのAIは、どちらが優れているかという単純な比較はできません。それぞれに明確な得意・不得意があるからです。
AlphaFold3が得意な領域:
- 巨大で複雑な複合体: リボソームのような巨大な分子や、抗体医薬の開発においては、AlphaFold3の構造予測能力が群を抜いています。
- 多様な修飾: 糖鎖修飾など、タンパク質の表面における複雑な化学修飾を考慮した構造予測に強みを持っています。
Boltz-2が得意な領域:
- 大規模スクリーニング: 何万もの化合物の中から、結合が強い上位の候補を高速にランク付けする作業(バーチャルスクリーニング)に最適です。
- 特定の柔軟な分子: マクロサイクルと呼ばれる特殊な環状構造を持つ薬剤候補に対して、高い予測精度を示します。
一方で、Boltz-2にも弱点はあります。タンパク質の構造が大きく変化するようなケース(アロステリック変化)や、結合部位にある「水分子」が重要な役割を果たすケースでは、予測精度が低下することが報告されています。
5.最強の布陣:統合ワークフローによる創薬の加速
5.1. 相互補完による「3段階プロセス」の提案
現在の計算創薬の現場では、AlphaFold3とBoltz-2を競合させるのではなく、組み合わせることで最強のワークフローを構築しています。具体的には、以下の3つのステップで進められます。
Step 1: 構造の取得(AlphaFold3) まず、標的となるタンパク質の詳細な「地図」を手に入れるためにAlphaFold3を使用します。特に構造が未知のタンパク質の場合、AlphaFold3が予測する高精度の3Dモデルが、創薬のスタート地点となります。
Step 2: 高速な選別(Boltz-2) 次に、Step 1で得られた構造に対して、何万種類もの化合物ライブラリをBoltz-2に投入します。Boltz-2は、構造的な整合性だけでなく「結合親和性」を指標にして、有望な化合物を高速に絞り込みます(トリアージ)。ここで、候補を数千から数百程度まで一気に圧縮します。
Step 3: 精密な検証(FEP / ABFE) 最後に、Boltz-2で選ばれた精鋭の化合物に対して、計算コストは高いものの物理学的に最も信頼性の高い「FEP(自由エネルギー摂動法)」などのシミュレーションを行い、最終的な結合の強さを確定させます。
5.2. 臨床現場へのインパクト
この「AlphaFold3で地図を作り、Boltz-2で候補を絞り、物理計算で確証を得る」という流れは、新薬開発の初期段階(リード化合物の探索)にかかる時間を、数年から数ヶ月単位に短縮する可能性を秘めています。
これは、難病や希少疾患に対する治療薬が、より早く患者さんの元へ届くようになることを意味します。また、開発コストの削減は、長期的には高騰する薬剤費の抑制にも寄与することが期待されます。
6.結論:AIと専門家の協働が拓く未来
AI技術は日進月歩ですが、それ単体ですべての創薬プロセスが完結するわけではありません。
AlphaFold3が提示する構造には「物理的な矛盾はないか?」、Boltz-2が予測した親和性は「実験結果と整合するか?」といった判断には、依然として化学や生物学に精通した専門家の知見が不可欠です。
しかし、AlphaFold単独では限界があったとしても、Boltz-2や従来の物理シミュレーションと組み合わせることで、創薬研究に革命的な貢献をもたらすことは間違いありません。
私たち医療関係者も、こうした「AI創薬」によって生み出された新しい薬剤が、近い将来、臨床の現場に次々と登場してくる時代に備える必要があります。AIはもはやSFの世界の話ではなく、明日の医療を支える強力なパートナーとなっているのです。
免責事項
本記事で提供するAlphaFold3およびBoltz-2に関する情報は、公開されている研究論文や最新の発表に基づき、専門家として正確性を期して作成していますが、その内容の完全性、正確性、および特定の目的への適合性を保証するものではありません。AI創薬技術は急速に進化しており、情報は常に更新されています。本記事は情報提供のみを目的としており、読者の皆様が本記事の情報に基づいて行ったいかなる行動や、それに起因する損害・結果について、一切の責任を負いません。 最終的な薬剤開発や意思決定においては、必ず公的な情報源や専門家の見解を参照し、ご自身の責任と判断のもとで実行してください。
本記事は生成AI (Gemini)を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「実験医学 2023年10月 Vol.41 No.16 AlphaFoldの可能性と挑戦〜すぐ始められる構造・機能予測から、複合体予測やタンパク質デザインへの応用まで」を見る