1.はじめに:予測から設計へ、AI創薬のパラダイムシフト
2025年も終わろうとしている今、医療の現場ではAIの活用が日常のものとなりつつあります。診断支援やカルテ作成におけるAIの活躍は目覚ましいですが、裏側の「創薬研究」の世界では、さらにドラスティックな革命が進行していることをご存知でしょうか?
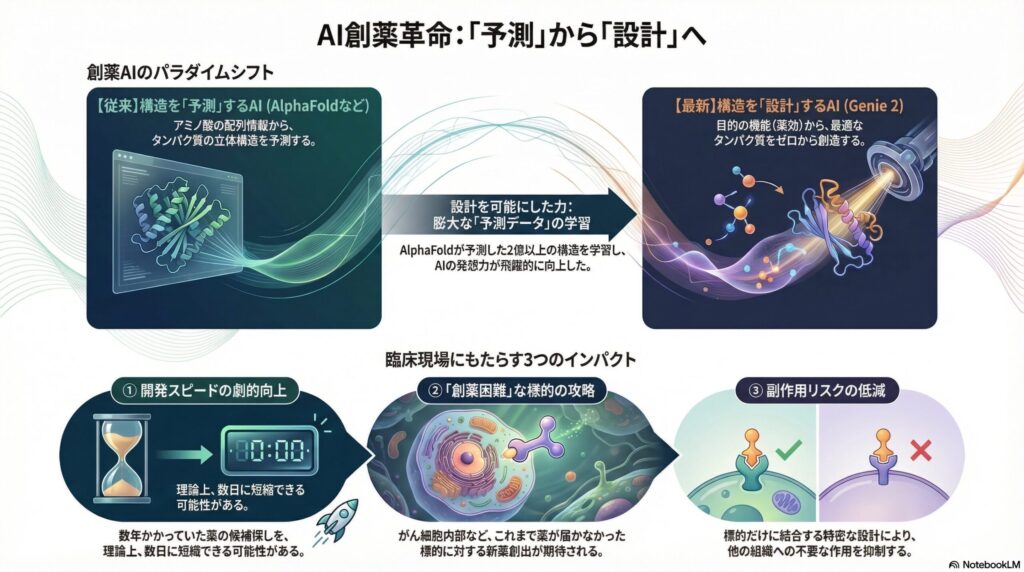
これまで、創薬におけるAIの主役はGoogle DeepMindの「AlphaFold」に代表される「構造予測AI」でした。これは、「アミノ酸の並び順(配列)」から「どんな形(構造)になるか」を予測する技術です。しかし、今注目されているのは、その逆を行う「構造設計AI」です。「こんな機能を持つ薬が欲しい」という設計図から、最適なタンパク質をゼロから作り出す技術であり、その最先端に位置するのが今回ご紹介する「Genie 2」です。
本記事では、最新のタンパク質設計モデルGenie 2が、どのように難治性疾患の治療薬開発を変えようとしているのか、医療関係者の皆様に向けて詳しく解説していきます。
2.Genie 2の正体:AlphaFold Databaseを学習した「創造する知能」
【キーワード:拡散モデル、AlphaFold Database】
Genie 2(ジーニー・ツー)は、画像生成AIなどで有名な「拡散モデル(Diffusion Model)」をタンパク質設計に応用したAIモデルです。ノイズ(雑音)から徐々に意味のある画像を浮かび上がらせるように、Genie 2はランダムな原子の配置から、機能を持つタンパク質の構造を生成します。
既存のモデルとの決定的な違いは、「学習データの質と量」にあります。
これまでの設計AI(RFdiffusionなど)は、主に「PDB(Protein Data Bank)」というデータベースで学習していました。ここには実験的に構造が解明されたタンパク質が登録されていますが、言い換えれば「結晶化しやすい(構造解析しやすい)タンパク質」にデータが偏っているという課題がありました。
対してGenie 2は、AlphaFoldによって予測された2億個以上もの構造データ(AlphaFold Database)を学習に取り入れています。 これにより、実験室では扱いにくかった複雑な形状や、自然界には稀にしか存在しない多様なタンパク質のパターンをAIが習得しました。「教科書(実験データ)」だけでなく、「シミュレーション(予測データ)」も含めて広範囲に学習したことで、AIの発想力が飛躍的に向上したのです。
3.デノボ設計とスキャフォールディング:創薬の「不可能性」を突破する
【キーワード:デノボ設計、モチーフ・スキャフォールディング】
では、具体的にGenie 2は何ができるのでしょうか? 医療応用において特に重要な2つの機能を紹介します。
① デノボ(De novo)タンパク質設計 「デノボ」とはラテン語で「新たに」という意味です。既存のタンパク質の改変ではなく、自然界に存在しない全く新しいタンパク質をゼロから設計することを指します。 Genie 2は、最大500アミノ酸残基(※)程度の大きさまで、安定した構造を持つタンパク質を生成可能です。 (※注:アミノ酸残基とは、タンパク質を構成するアミノ酸の単位のことです。従来のAI記事で「炭素数」と誤訳されることがありますが、正しくは残基数です。)
これにより、従来の低分子医薬品や抗体医薬品では狙えなかった、細胞内の複雑なターゲットに結合する薬剤を創出できる可能性があります。
② モチーフ・スキャフォールディング これが現在の創薬で最もホットな技術です。 例えば、ウイルス表面の特定の場所に結合して無力化する「鍵(モチーフ)」となる小さなパーツが見つかったとします。しかし、この小さなパーツだけでは体内で不安定です。そこで、このパーツを適切な位置に固定するための「土台(スキャフォールド)」が必要になります。
Genie 2はこの能力が極めて高く、24の課題タスクにおいて23を解決するという驚異的なスコアを記録しました。特に、RSV(RSウイルス)のGタンパク質といった、従来AI(RFdiffusion)が苦手としていたターゲットに対しても、最適な土台を設計することに成功しています。これは、ワクチン開発や中和抗体の設計において強力な武器となります。
4.臨床現場への恩恵:開発期間の短縮と副作用の軽減
【キーワード:リード化合物、標的特異性】
医師や薬剤師の皆様にとって最も関心があるのは、「実際にいつ、どんな薬が届くのか」という点でしょう。Genie 2の導入は、臨床現場に以下のメリットをもたらすと期待されています。
- 開発スピードの劇的な向上 通常、ターゲットに対するリード化合物(薬の種)を見つけるには、数ヶ月から数年のスクリーニングが必要です。Genie 2を用いれば、理論上最適な構造を数日で数千通り設計し、その中から有望なものを絞り込むことができます。これにより、パンデミック時のワクチン開発や、進行の早い希少疾患への対応速度が上がります。
- 「Undruggable(創薬困難)」ターゲットの攻略 がん細胞の内部にある特定のタンパク質など、これまで「薬を作るのが無理」とされてきた標的に対し、Genie 2はこれまでにない形状のバインダー(結合タンパク質)を提案できます。これにより、治療法がなかった疾患に新たな選択肢が生まれます。
- 副作用の低減 標的だけに強固に結合し、他の組織には作用しないような厳密な構造設計が可能になります。AIによるシミュレーション段階で構造を最適化することで、臨床試験での予期せぬ毒性を減らし、ドロップアウトのリスクを下げることにつながります。
5.2025年の現在地と今後の課題:ウェットとドライの融合
【キーワード:がん免疫療法、ウェット実験】
2025年12月現在、Genie 2を活用したプロジェクトは、特に以下の領域で進んでいます。
- がん免疫療法:PD-1/PD-L1に続く、新しい免疫チェックポイント阻害剤の設計。
- 遺伝性疾患:欠損した酵素の代わりとなる、より安定で長時間作用する人工タンパク質の開発。
しかし、課題もあります。Genie 2が「設計」したタンパク質は、あくまで計算機上の存在です。これらが本当に細胞内で作れるのか、期待通りの機能を示すのかは、実際の実験(ウェット実験)で検証しなければなりません。 「AIが描いた設計図」を「実際の物質」にする過程での成功率をどう上げるか。これが現在の競争の主戦場であり、AI研究者と実験生物学者の連携(ドライとウェットの融合)がかつてないほど重要になっています。
6.さいごに:医療者がAI創薬に期待すべきこと
Genie 2のような高度な生成AIの登場は、創薬を「発見するプロセス」から「設計するプロセス」へと変えました。 これは、建築家が自然の洞窟を探すのをやめ、目的に合わせたビルを建て始めるようなものです。
私たち医療従事者が待望する「副作用が少なく、安価で、効果の高い薬」。 それを届けるまでの道のりは、Genie 2という強力なエンジンの登場によって、確実に短縮されています。今後の臨床試験の結果報告を目にする際は、その背後にこうした「設計AI」の存在があることを思い出していただければ幸いです。
免責事項
- 本記事は、2025年12月時点の公開情報および研究論文に基づき作成されていますが、その正確性、完全性、有用性を保証するものではありません。
- 本記事は情報提供のみを目的としており、医師による診断、治療、その他医学的なアドバイスを代替するものではありません。
- 本記事の情報を利用した結果生じた、いかなる損害、損失、トラブルについても、当方は一切の責任を負いません。情報の活用は、ご自身の判断と責任において行ってください。
本記事は生成AIを活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「【サイエンス雑誌】 AI技術が変革する創薬と治療 – 新薬開発から精密医療まで、人工知能が導く未来の医療革命: 世界のライフサイエンス研究トレンドをレポート ー バイオクイックニュース サイエンス雑誌バイオクイックニュース」を見る