1.はじめに:なぜ今、AI創薬に「グラフ」が必要なのか
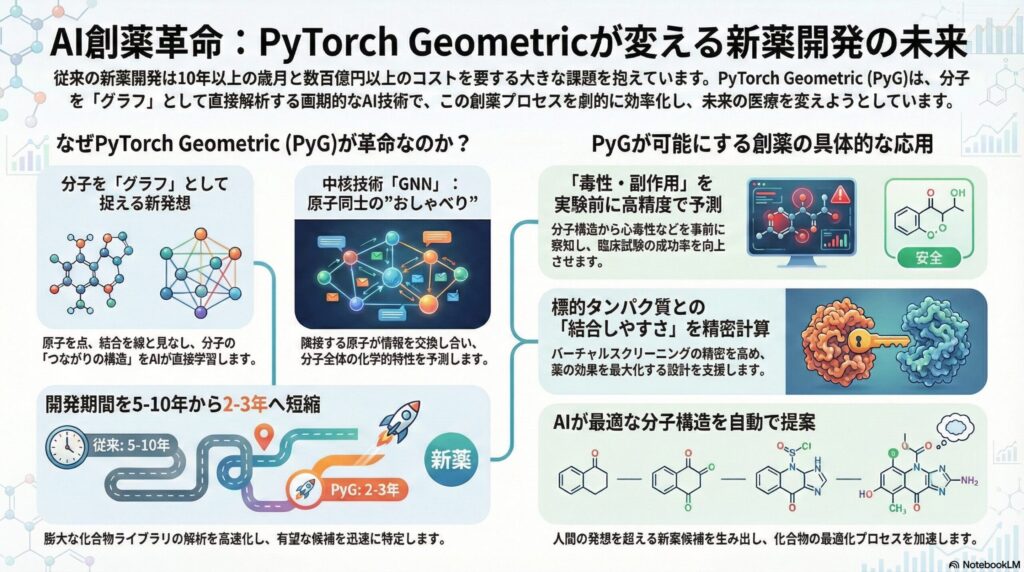
現代の新薬開発には、膨大な時間とコストがかかることが大きな課題となっています。一つの薬が世に出るまでに、10年以上の歳月と数百億から数千億円もの投資が必要と言われています。このプロセスを劇的に効率化する鍵として注目されているのが、人工知能(AI)による創薬です。特に「PyTorch Geometric(PyG)」というライブラリ(プログラムの部品集)は、分子の構造をそのままの形で扱うことができるため、創薬の現場で不可欠な存在となっています。
これまでのコンピューター解析では、分子を単なる「記号」や「固定された数値の列」として扱ってきました。しかし、実際の分子は、原子同士が結合し合い、三次元的に複雑な形を作っています。この「つながりの構造」をそのまま数学的に表現できるのが「グラフ」というデータ形式です。PyGは、このグラフ構造を深層学習(ディープラーニング)で直接処理するための強力なツールであり、現在のAI創薬の心臓部とも言える役割を担っています。
医療関係者の皆様にとって、AI創薬は少し遠い世界の技術に感じられるかもしれません。しかし、PyGによって予測された化合物の特性や毒性の情報は、将来的に臨床現場に届く薬の質を向上させ、副作用のリスクを低減することに直結します。本記事では、この革新的な技術であるPyGが、具体的にどのように薬の開発プロセスを変えているのか、その仕組みと未来について分かりやすく、丁寧に解き明かしていきたいと思います。
2.ステップ1:PyTorch Geometric(PyG)の基本概念と医療データの親和性
PyTorch Geometric(パイトーチ・ジオメトリック、通称PyG)は、AI開発で広く使われている「PyTorch」という土台の上で動く専門的な道具箱です。その名の通り、「幾何学的(Geometric)」な構造を持つデータを扱うのが得意です。ここで言う「幾何学的」とは、単なる写真のような画像データではなく、点と線で結ばれたネットワーク状のデータを指します。これを専門用語で「グラフデータ」と呼び、医療や化学の分野と非常に相性が良いのが特徴です。
医療の現場でも、グラフ構造は至る所に存在します。例えば、体内の代謝経路や信号伝達経路(パスウェイ)は、タンパク質や分子が互いに影響を与え合うネットワークです。また、新薬候補となる化合物そのものも、炭素や酸素といった原子(ノード:点)が共有結合(エッジ:線)で結ばれたグラフです。PyGは、これらの「つながり」の中に隠されたパターンを見つけ出すことができるため、従来の解析手法では見落とされていた化合物の特徴を抽出することが可能になります。
なぜ、PyGがこれほどまでに支持されているのでしょうか。その理由は、大規模で複雑なデータを高速かつ効率的に処理できる設計にあります。製薬企業が保有する数百万件という化合物のライブラリを、一つずつ解析していては時間が足りません。PyGは、コンピューターの計算機(GPU)を最大限に活用し、これら膨大なグラフデータを並列で一気に処理する仕組みを持っています。これにより、研究者はアイデアを即座にシミュレーションし、結果を得ることができるようになったのです。
3.ステップ2:グラフニューラルネットワーク(GNN)の仕組みを直感的に理解する
PyGの中核をなす技術が「グラフニューラルネットワーク(GNN)」です。これは、AIの一種であるニューラルネットワークをグラフデータに適応させたものです。一般的なAIは、画像のピクセルの並びや文章の単語の順序を学習しますが、GNNは「どの原子が、どの原子の隣にあるのか」という情報のつながりを学習します。これを直感的に説明すると、分子の中の各原子が、隣り合う原子と「おしゃべり」をして情報を交換するようなイメージです。
この情報の交換プロセスを「メッセージパッシング」と呼びます。例えば、ある原子が「私は今、マイナスの電荷を帯びているよ」という情報を隣の原子に伝えます。受け取った原子は、その情報を自分の情報と統合し、さらに別の隣の原子へと伝えていきます。このプロセスを繰り返すことで、分子全体の雰囲気や、特定の部位が持つ化学的な特性(反応のしやすさなど)が、数値として浮き彫りになってくるのです。これが、GNNによる分子の「特徴抽出」です。
この技術の素晴らしい点は、人間が「この構造があると毒性が出やすい」といったルールをあらかじめ教え込む必要がないことです。AIは膨大な過去の実験データを学習することで、自ら「どのようなつながりのパターンが、特定の薬効や副作用に関連しているか」を発見します。PyGには、このメッセージパッシングを高度に洗練させた様々なアルゴリズム(GCNやGATなど)が搭載されており、研究者は目的に合わせて最適な手法を選択することができるようになっています。
4.ステップ3:AI創薬における具体的な活用法(特性予測と安全性評価)
PyGが最も威力を発揮する場面の一つが「分子特性予測」です。これは、新薬の候補となる化合物が、生体内でどのような挙動を示すかを、実際に実験を行う前にコンピューター上で予測する技術です。例えば、薬が血液中に溶けやすいか(溶解性)、肝臓で適切に代謝されるか(代謝安定性)、あるいは意図しない細胞に対して攻撃性を持たないか(毒性予測)といった項目を、PyGを用いたモデルで高精度に算出します。
特に医療従事者の皆様が関心を持たれるのは「毒性予測(Tox21)」や「副作用予測(SIDER)」ではないでしょうか。これまでは、動物実験や初期の臨床試験で初めて発覚していた深刻な副作用を、PyGを用いたAIは、分子構造のグラフを読み解くだけで事前に察知しようとしています。これは、臨床試験の成功率を飛躍的に高めるだけでなく、倫理的な観点からも非常に意義のある進歩です。AIが「この分子構造は心毒性のリスクが高い」と警告を発すれば、その化合物は早い段階で除外されます。
さらに、薬物動態学的な指標であるADME(吸収・分布・代謝・排泄)の予測にもPyGは活用されています。患者様の体内で薬がどのように広がり、どのように消失していくかを予測することは、適切な投与量や投与間隔を決定する上で極めて重要です。PyGは、分子の微細な構造の違いがADMEに与える影響を敏感に捉えることができるため、より安全で効果的な薬の設計(デザイン)が可能になります。これにより、将来的に、より副作用の少ない薬が臨床現場に届けられることが期待されています。
5.ステップ4:標的タンパク質との相互作用を読み解く「結合親和性予測」
薬が効果を発揮するためには、体内の特定のタンパク質(ターゲット)に鍵と鍵穴のようにぴったりと結合する必要があります。この「結合のしやすさ」を予測することを、結合親和性予測と呼びます。PyGは、化合物(リガンド)だけでなく、巨大なタンパク質の立体構造もグラフとして捉えることができます。タンパク質は多くのアミノ酸が連なった複雑な構造をしていますが、PyGを使えば、どのアミノ酸と化合物がどの地点で接触するかを精密に計算できるのです。
従来の解析手法では、タンパク質の形状を単純化しすぎるか、あるいは計算に膨大な時間がかかりすぎていました。しかし、PyGを基盤とした最新のAIモデルは、タンパク質と化合物の両方をグラフとして入力し、それらが「相互に情報を交換する」過程をシミュレーションします。これにより、従来のハイスループットスクリーニング(数万個の化合物を実際に試験管で試す作業)をコンピューター上で代替する「バーチャルスクリーニング」の精度が飛躍的に向上しました。
この技術の応用例として、近年では既存の薬を別の疾患に転用する「ドラッグ・リポジショニング」も活発に行われています。例えば、ある抗がん剤が、別の未知の標的タンパク質にも結合する可能性があることをPyGが発見する、といったケースです。これにより、すでに安全性が確認されている薬から、新しい治療法を迅速に見つけ出すことが可能になります。これは、治療法の確立が急がれる難病や新興感染症の対策において、極めて強力な武器となります。
6.ステップ5:化合物最適化と構造改良のプロセスを高速化する
有望な新薬候補が見つかったとしても、そのままでは薬として使えないことがほとんどです。効果をより強めたり、副作用を弱めたりするために、分子の形を少しずつ変えて調整する作業が必要です。これを「化合物最適化」と呼びます。これまでは化学者の経験と直感に頼って、数カ月かけて構造を改良してきましたが、PyGはこのプロセスを「データ駆動型」へと変貌させました。
PyGを用いたAIモデルは、構造と活性の相関関係(SAR:構造活性相関)を深く学習します。例えば、「この部分に酸素原子を一つ付け加えると、ターゲットへの結合力が10倍になる」といった予測をAIが行います。さらに最近では、AI自身が新しい分子構造を提案する「生成モデル(Diffusionモデルなど)」とPyGを組み合わせる技術も進化しています。これにより、人間の想像力を超えた、全く新しい骨格を持つ画期的な新薬候補が、AIの手によって生み出されようとしています。
この高速化の恩恵は、研究開発期間の短縮という形で見えてきています。従来、薬の種(シード)を見つけてから臨床試験に入るまでに5年から10年かかっていた期間が、AIの導入により2年から3年にまで短縮される事例も出てきています。医療の現場で待っている患者様に、一日でも早く、より優れた治療薬を届けるために、PyGを筆頭とするAI技術は、今や創薬研究において「なくてはならないパートナー」となっているのです。
7.まとめと今後の展望:AI創薬が医療現場にもたらすインパクト
ここまで見てきたように、PyTorch Geometric(PyG)は、分子を「グラフ」という自然な形で扱うことで、創薬プロセスのあらゆる段階に革新をもたらしています。特性予測から毒性の回避、標的への結合、そして新しい構造の提案まで、その応用範囲は多岐にわたります。これは単なるコンピューター技術の進歩ではなく、新薬開発の成功率を上げ、医療全体の質を向上させるための、医学的・薬学的な大きな転換点と言えるでしょう。
今後の展望としては、PyGを用いたAIモデルが、さらに多様なデータと統合されていくことが期待されています。例えば、個々の患者様のゲノム情報や臨床データ(リアルワールドデータ)と、分子グラフの情報を組み合わせることで、特定の体質の人にだけ効果を発揮する「精密医療(プレシジョン・メディシン)」のための創薬も加速するはずです。また、AIがなぜその化合物を「良い」と判断したのか、その理由を人間に説明する「説明可能なAI(XAI)」の研究も進んでおり、研究者がより納得感を持ってAIの提案を採用できるようになるでしょう。
AI創薬の進化は止まりません。PyGのような基盤技術が進化し続けることで、私たちは近い将来、これまでは「不治の病」とされていた疾患に対する特効薬が、驚くべきスピードで開発される瞬間を目の当たりにするかもしれません。医療関係者の皆様におかれましては、これらの技術が作り出す新しい薬が、どのような科学的背景を持って生まれてくるのかを知っておくことが、次世代の医療を支える一助となれば幸いです。
免責事項
本記事は、AI創薬における技術的なトレンドとPyTorch Geometricの一般的な活用事例を紹介することを目的としています。提供される情報の正確性については細心の注意を払っておりますが、急速に進化する分野であるため、常に最新の学術論文や公式ドキュメントを確認することを推奨します。なお、本記事の内容に基づいて行われた一切の行為や、その結果生じた損害について、筆者および当ブログは一切の責任を負わないものとします。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「PyTorch実践入門 ~ ディープラーニングの基礎から実装へ」を見る