1.はじめに:AIが切り拓く新しい創薬のカタチ
現代の創薬において、最も時間がかかり、かつ重要な工程の一つが「新薬の種(候補化合物)」を見つけ出す作業です。これまで、コンピューター上で化合物とタンパク質の結合をシミュレーションする「分子ドッキング」という手法が使われてきました。
しかし、従来の手法では計算に膨大な時間がかかったり、予測精度が不十分だったりと、多くの課題を抱えていました。そんな中、2022年に登場した「DiffDock(ディフドック)」というAI技術が、世界中の製薬企業や研究者の注目を集めています。
本記事では、このDiffDockがなぜ「革新的」と言われるのか、その仕組みと医療現場・創薬研究に与えるインパクトを、専門外の方にも分かりやすく丁寧に解説していきます。
2.Step 1:そもそも「分子ドッキング」とは何か?
分子ドッキングとは、一言で言えば「タンパク質という鍵穴に対して、薬という鍵がピタリとはまるか」をコンピューター上で予測する作業のことです。鍵が正確にはまれば、その化合物は薬としての効果を発揮する可能性があります。
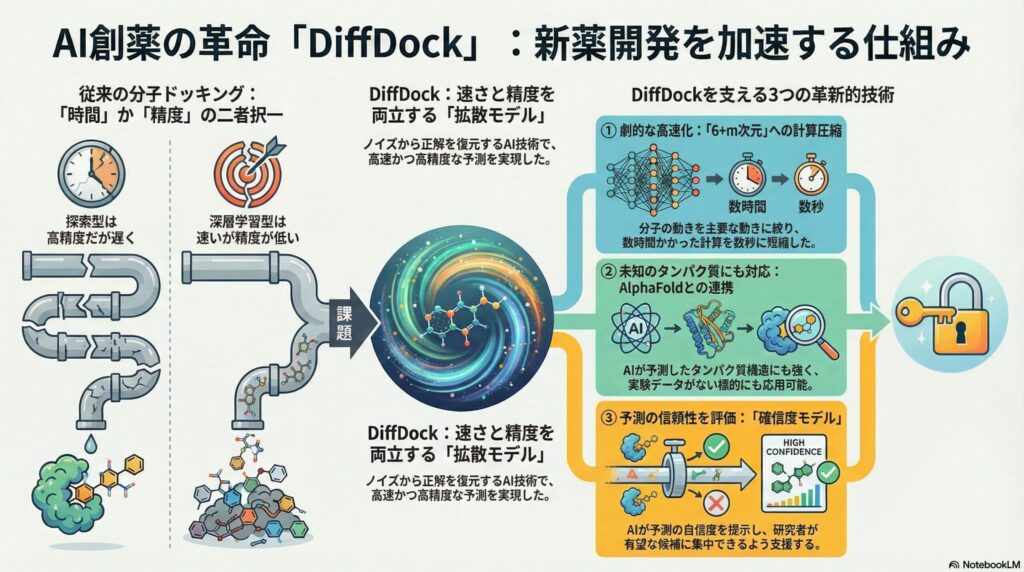
従来の主流な方法は、数万通りの角度や位置を力任せに計算する「探索型」か、過去のデータを学習して一気に答えを出す「深層学習型」でした。しかし、探索型はスーパーコンピューターを使っても時間がかかりすぎ、深層学習型はスピードは速いものの精度が低いという弱点がありました。
DiffDockは、画像生成AIなどで使われる最新の技術を活用することで、これら両方の「いいとこ取り」を実現しました。これにより、従来よりもはるかに速く、かつ正確に薬の候補を見つけ出すことが可能になったのです。
3.Step 2:DiffDockの核となる「拡散モデル」の仕組み
DiffDockの最大の特徴は、「拡散モデル(Diffusion Model)」というAIアルゴリズムを採用している点にあります。これは、近年の画像生成AI(MidjourneyやStable Diffusionなど)で一躍有名になった技術です。
拡散モデルとは、わざとノイズを加えてボロボロにした情報から、元の綺麗な状態を少しずつ復元していくプロセスのことです。これを分子ドッキングに応用し、「デタラメな位置にある分子」を、正しい結合位置へと少しずつ誘導していくのがDiffDockの仕組みです。
この「段階的に調整していく」というアプローチにより、一発で正解を当てるよりも遥かに高い精度で、分子の最適な位置(ポーズ)を特定することができるようになりました。霧の中から徐々に目的地の輪郭が見えてくるようなイメージです。
4.Step 3:複雑な分子の動きを「6+m次元」で効率化
分子は3次元空間を自由に動くだけでなく、自分自身の形もぐにゃぐにゃと曲がります。本来、この動きをすべて計算しようとすると膨大な計算量が必要になりますが、DiffDockはこれを賢く簡略化しています。
具体的には、分子全体の移動(3方向)、回転(3方向)、そして分子の関節にあたる部分の曲がり(m個)だけに注目します。これを専門用語で「6+m次元」への圧縮と呼び、計算の無駄を徹底的に削ぎ落としています。
この工夫により、計算スピードが劇的に向上しました。これまでは1つの化合物を調べるのに数分から数時間かかっていたものが、わずか数秒で完了します。これは、数百万種類の化合物を網羅的に調べる「スクリーニング」において決定的な差となります。
5.Step 4:予測構造(AlphaFold)との高い親和性
医療関係者の皆様は、AIがタンパク質の形を予測する「AlphaFold2」という言葉を耳にしたことがあるかもしれません。実は、DiffDockはこのAlphaFold2などが作った「予測上のタンパク質構造」に対しても非常に強いという特徴があります。
従来のソフトは、実際の実験(X線結晶構造解析など)で得られた「完璧なタンパク質の形」がないと上手く機能しませんでした。しかし、実験データがない未知のタンパク質に対しても、DiffDockは高い精度で薬の結合を予測できます。
これは、まだ治療法が見つかっていない難病や、新しく出現したウイルスのタンパク質に対しても、即座に創薬研究を開始できることを意味します。実験データの制約を飛び越えたこの能力こそが、DiffDockの真の強みなのです。
6.Step 5:確信度モデルによる「ハズレ」の排除
AIは時に、自信満々に間違った答えを出すことがあります。DiffDockはこれを防ぐために、「確信度モデル(Confidence Model)」という二段構えのシステムを搭載しています。
一段目のAIが「こんな結合の形はどうだろう?」と候補を出し、二段目のAIが「その形が正解である確率は何%か?」と評価します。このダブルチェック機能により、研究者は信頼性の高いデータだけをピックアップして、次の実験に進むことができます。
これにより、実験室での検証作業(ウェット実験)の失敗を大幅に減らすことができます。時間とコストがかかる創薬現場において、この「確信度」という指標は、研究の優先順位を決めるための極めて重要な判断材料となります。
7.Step 6:今後の展望と医療へのインパクト
DiffDockは現在も進化を続けており、さらに高速で正確な後継モデルが次々と発表されています。この技術が普及することで、これまで10年以上の歳月と数千億円の費用がかかっていた新薬開発のプロセスが、大きく短縮されることが期待されています。
将来的には、患者さん一人ひとりのタンパク質の変異に合わせた「個別化医療」のための薬選びや、既存の薬を別の疾患に転用する「ドラッグリポジショニング」にも、この技術が応用されるでしょう。
AIはもはや研究室の中だけのツールではなく、臨床現場に届く新しい治療薬を生み出すための強力なエンジンとなっています。DiffDockはそのエンジンの中でも、最も高性能なターボチャージャーの一つと言える存在なのです。
免責事項
本記事は技術解説を目的としたものであり、特定の薬剤や治療法を推奨するものではありません。情報の正確性には細心の注意を払っておりますが、最新の研究結果により内容が更新される可能性があります。本記事の情報に基づいて行われた行為について、執筆者および当ブログは一切の責任を負わないものとします。最新の技術実装については、必ず一次文献や公式ドキュメントをご確認ください。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「インシリコ創薬: 計算創薬の基礎から実例まで」を見る