1.はじめに:医療現場とAI創薬の距離
現在、私たちが日常的に処方し、使用している薬剤の裏側では、驚異的なスピードで「デジタル変革」が起きています。かつて一つの新薬を開発するには、10年以上の歳月と数千億円の費用が必要でした。しかし、今そのプロセスを劇的に短縮しているのが「AI創薬」です。
そのAI創薬の心臓部とも言えるツールが、今回ご紹介する「RDKit(アールディーキット)」です。本記事では、医療関係者の皆様に向けて、このツールがどのように薬の種(リード化合物)を見つけ出し、安全性を評価しているのかを分かりやすく解説します。
2.RDKitとは何か?AI創薬を支える「デジタルの物差し」
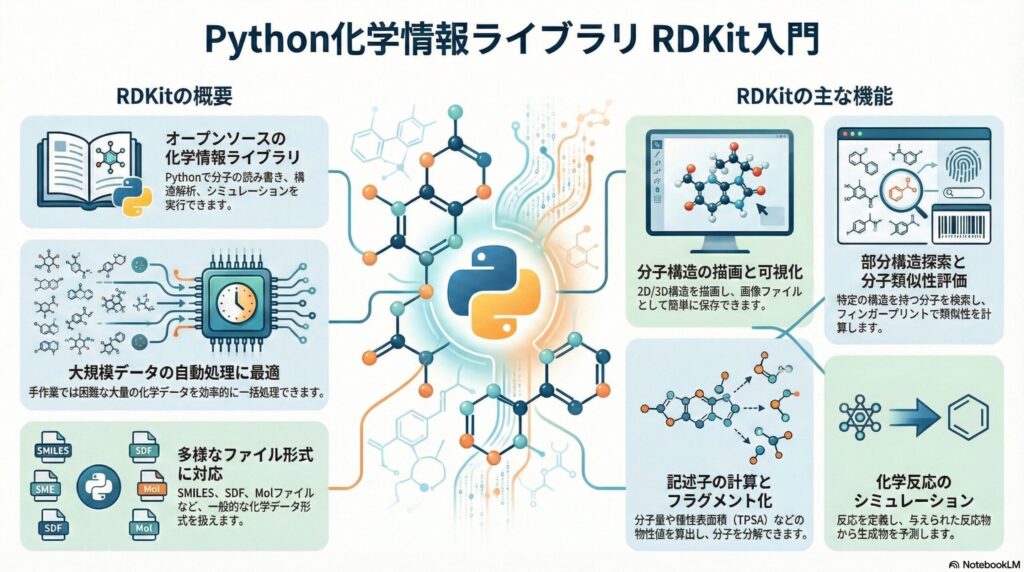
RDKitは、化学構造をコンピューターで扱うための「化学情報学(ケモインフォマティクス)」用ツールキットです。オープンソースとして無料で提供されており、世界中の製薬企業や大学の研究者が利用しています。いわば、デジタルの世界で化合物を計り、形作り、評価するための「万能な物差し」のような存在です。
このツールが優れている点は、化合物の構造式(SMILES:スマイルス)という文字列から、その物質の物理的な性質や、生物学的な活性を瞬時に計算できることです。C++という高速な言語で開発されているため、数百万個という膨大な化合物データを短時間で処理することが可能です。
3.ステップ1:化合物の「デジタル化」と基本操作
創薬の第一歩は、化合物をコンピューターが理解できる形式に変換することから始まります。RDKitは「SMILES」と呼ばれる表記法を用います。例えば、ベンゼンは「c1ccccc1」という文字列で表されます。これを入力するだけで、RDKitはその構造を認識し、画面上に美しい2次元図や3次元モデルを描き出します。
さらに、分子量や脂溶性(LogP)といった、薬としての「顔つき」を決める数値(分子記述子)を計算します。医療現場で薬剤の吸収率を考える際に重要なこれらの指標が、プログラム一行で算出できるのです。これにより、研究者は実験室に立つ前に、コンピューター上で数万通りのシミュレーションを行うことができます。
4.ステップ2:Lipinskiの法則による「薬らしさ」の選別
全ての化合物が薬になれるわけではありません。RDKitの重要な役割の一つに、有望な候補を絞り込む「フィルタリング」があります。ここでよく用いられるのが、有名な「LipinskiのRule of Five(リピンスキーの法則)」です。これは、経口投与に適した薬が備えるべき4つの物理化学的条件を指します。
具体的には、分子量が500以下であることや、水素結合供与体の数が5個以下であることなどが挙げられます。RDKitはこのルールを自動で適用し、膨大なライブラリの中から「経口薬として吸収されやすい形」をした化合物だけを抽出します。この工程により、失敗する可能性の高い候補を早い段階で排除し、研究の効率化を図っています。
5.ステップ3:3次元構造の生成と標的タンパク質への適合
薬が効果を発揮するためには、体内の標的タンパク質(受容体や酵素)に、鍵と鍵穴のようにぴったりとはまる必要があります。RDKitは、化合物の平面的な情報から、エネルギー的に安定した「3次元構造」を予測して生成する機能を持っています。
最新のRDKit(2024.09.1版)では、「ETKDG法」という実験データに基づいた高度なアルゴリズムが採用されており、非常に高精度な立体構造の再現が可能です。この3Dモデルを用いることで、コンピューター上でのドッキングシミュレーションが可能になり、より精度の高い活性予測が実現しています。
6.ステップ4:PAINSフィルタリングで「偽の反応」を防ぐ
創薬研究において、実験データ上で活性があるように見えても、実際にはタンパク質と非特異的に反応しているだけの「偽陽性」化合物が問題となります。これらは「PAINS(パインズ)」と呼ばれ、開発を停滞させる大きな原因となります。
RDKitには、このPAINS構造を自動的に検出して除外する機能が備わっています。過去の膨大な失敗データから学んだ「要注意構造」をデータベース化しており、それを照合することで、筋の良い化合物だけを次のステップへ進めることができます。これにより、臨床試験に進んだ際の成功率を高めることに貢献しています。
7.AIと機械学習の統合:次世代の創薬ワークフロー
RDKitの真の真価は、最新のAI(人工知能)や機械学習との連携にあります。化合物の特徴を「フィンガープリント」と呼ばれる0と1のデジタル符号(ビット列)に変換することで、ディープラーニングモデルへの入力データを作成します。
例えば、特定の受容体に結合する化合物の共通パターンをAIに学習させれば、RDKitを使ってまだ見ぬ新化合物の活性を予測することができます。2025年に向けて、生成AIとの統合も進んでおり、AIが「RDKitの基準を満たす新しい薬の設計図」を自ら書き換えるような時代が到来しています。
8.2024-2025年の最新アップデート:何が変わったのか?
2024年9月にリリースされた最新バージョンでは、医療データとの連携がさらに強化されました。特に「分子標準化パイプライン」の改善により、異なるデータベース間で化合物の表記が微妙に異なる問題を自動で解決できるようになりました。
また、マルチスレッド処理(複数の計算を同時に行う技術)の効率化により、計算速度がさらに向上しました。これにより、個々の患者の遺伝子情報に合わせた「個別化医療」のための化合物設計など、より複雑で膨大な計算が求められる領域でも、RDKitが強力な武器として機能し始めています。
9.おわりに:未来の医療を支えるオープンソースの力
RDKitは、一部の専門家だけのものではありません。そのオープンな性質により、世界中の知見が集約され、日々アップデートされています。新薬開発のスピードが上がることは、未だ治療法のない疾患に苦しむ患者さんに、一日も早く希望を届けることにつながります。
医療関係者の皆様が、処方箋の向こう側にある「化合物」の成り立ちに興味を持っていただけるなら、RDKitはその奥深い世界への最高の入り口となるはずです。AI創薬がもたらす革新は、まさに今、この瞬間もRDKitというツールを通じて進行しているのです。
免責事項
本記事に記載された情報は、執筆時点での技術的知見に基づいています。RDKitの使用方法や創薬プロセスに関する解釈は多岐にわたり、個別の研究結果を保証するものではありません。本記事の利用により生じたいかなる損害についても、筆者および当ラボは一切の責任は負わないものとします。実際の研究や業務への適用に際しては、公式ドキュメントを確認し、専門家の指導を仰いでください。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「ケモ・マテリアルズ・インフォマティクス入門: RとPythonによる基礎と実践」を見る