1. はじめに:なぜ医療関係者が「タンパク質構造予測」を知るべきなのか
医療の進歩は、常に「分子レベルでの理解」とともにありました。特定の疾患がなぜ起こるのか、ある薬剤がなぜ効くのか。その答えの多くは、タンパク質という生体内の「部品」の形に隠されています。
かつて、この「形」を一つ突き止めるには、数年間の歳月と数千万円の費用、そして高度な実験技術が必要でした。しかし、2020年代、AI技術の飛躍によってその常識が覆されました。今や、コンピューター上で数分あれば、驚くほど正確な構造が得られる時代です。
本記事では、現在のAI創薬を牽引する4つの主要ツールをピックアップし、医療関係者の皆様に向けて、それぞれの特徴と医療現場・研究への応用可能性を分かりやすく解説します。
2. Step 1:全ての基礎、AlphaFold2とColabFoldを知る
まずは、この革命の先駆けとなったAlphaFold2(アルファフォールド2)から整理しましょう。2020年、Google傘下のDeepMind社が開発したこのAIは、タンパク質の構造予測精度を劇的に向上させ、生命科学の世界に衝撃を与えました。
AlphaFold2の優れた点は、「進化の情報」を読み解く力にあります。生物が進化する過程で、重要な機能を持つ部分は変化しにくいという性質(保存性)を利用し、似たような配列を持つ多くのタンパク質を比較(MSA:多重配列アライメント)することで、その立体構造を予測します。
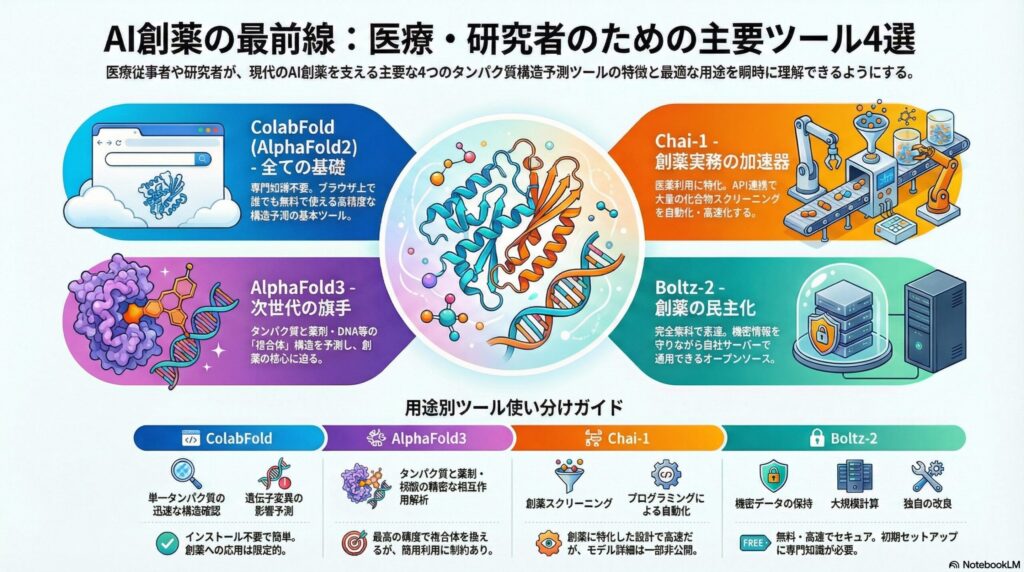
現在、多くの研究者が利用しているColabFold(コラボフォールド)は、このAlphaFold2をより高速に、かつブラウザ上で手軽に使えるようにしたツールです。専門的なサーバーを持たなくても、アミノ酸配列を入力するだけで、誰でも無料で高精度な構造を得ることができます。
医療現場においても、特定の遺伝子変異がタンパク質の立体構造にどう影響するかをシミュレーションする際、このツールは第一の選択肢となります。信頼性の指標であるpLDDTスコア(100点満点で、80点以上なら非常に信頼できる)を確認することで、予測結果の妥当性を判断できるのも特徴です。
3. Step 2:次世代の旗手、AlphaFold3による「複合体」予測の衝撃
2024年5月に登場したAlphaFold3は、これまでの「タンパク質の形を当てる」という枠組みを大きく広げました。最大の進化は、タンパク質だけでなく、DNA、RNA、さらには**低分子化合物(薬剤候補)**やイオンを含めた「複合体」の構造を予測できるようになった点です。
従来のAlphaFold2では難しかった「薬剤がタンパク質のどこに、どのように結合するか」という、創薬において最も重要なステップをAIが直接扱えるようになりました。これを実現したのが、画像生成AIなどでも使われる「拡散モデル(Diffusion Model)」という技術です。
拡散モデルは、最初はバラバラのノイズのような状態から、徐々に物理的に正しい形へと「磨き上げていく」手法です。これにより、分子同士の複雑な相互作用をより柔軟に捉えることが可能になりました。
ただし、注意点もあります。AlphaFold3は「形」は正確に予測しますが、その結合がどれくらい「強い」か(結合親和性)までは教えてくれません。医療応用においては、予測された形をベースにしつつ、実際の結合の強さは別の計算手法や実験で確かめる必要があります。
4. Step 3:創薬の実務を加速させるChai-1の可能性
AlphaFold3とほぼ同時期に登場し、注目を集めているのがChai-1(チャイ・ワン)です。これはAI創薬スタートアップであるChai Laboratoryが開発したモデルで、AlphaFold3に匹敵する性能を持ちながら、より産業利用(創薬研究)を意識した設計になっています。
Chai-1の強みは、開発ワークフローへの組み込みやすさにあります。API(プログラムから機能を呼び出す仕組み)を介して利用できるため、大量の化合物ライブラリの中から、特定の標的タンパク質に結合しそうなものを自動でスクリーニングするシステムを構築しやすいのが特徴です。
製薬企業の研究現場では、スピードが命です。Chai-1は、特定の条件下でAlphaFold3よりも高速に計算を完了できる場合があり、創薬の初期段階における試行錯誤の回数を劇的に増やすことができます。
医療関係者の皆様にとっては、近い将来、このChai-1のようなツールによって選別された「AI設計の薬剤」が臨床試験に次々と登場してくることになるでしょう。その背景にある技術として、この名前を覚えておいて損はありません。
5. Step 4:Boltz-2がもたらす「創薬の民主化」とデータの安全性
最後に紹介するのが、2024年後半に突如として現れた新星Boltz-2(ボルツ・ツー)です。このツールの最大の特徴は、「完全オープンソース」であるという点です。これは、AIの設計図や使い方が全て無料で公開されており、誰でも自分のパソコンやサーバーにインストールして使えることを意味します。
なぜこれが重要なのでしょうか? それは、情報の秘匿性に関わるからです。AlphaFold3のサーバー版などは便利ですが、予測したい配列や化合物のデータを外部(Googleのサーバーなど)に送信する必要があります。未発表の研究データや、企業の機密情報を扱う場合、これは大きなリスクとなります。
Boltz-2を使えば、自施設内のネットワークで完結して構造予測が行えるため、機密情報を守りながら最先端のAI技術を享受できます。また、計算速度も非常に高速で、AlphaFold3と同等の精度を保ちつつ、より多くの計算をこなすことが可能です。
MITライセンスという、商用利用にも極めて寛容な条件で公開されているため、大学の研究室からスタートアップ、大企業まで、Boltz-2はまさに「創薬の力をあらゆる人の手に届ける(民主化する)」象徴的なツールと言えます。
6. Step 5:臨床・研究における各ツールの使い分けガイド
これら4つのツールを、医療現場や研究でどのように使い分けるべきか、専門家の視点でまとめました。
| ツール名 | 推奨されるシチュエーション | メリット | デメリット |
| ColabFold | 単一タンパク質の迅速な構造確認、遺伝子変異の影響予測 | インストール不要、簡単、実績が豊富 | 薬剤やDNAとの結合予測には不向き |
| AlphaFold3 | タンパク質と薬剤・核酸の精密な相互作用解析 | 最高レベルの精度、全生体分子に対応 | 1日の利用回数制限、商用利用に制約 |
| Chai-1 | 創薬スクリーニング、プログラミングによる自動化 | 創薬特化の設計、APIによる連携が容易 | モデルの詳細が一部非公開 |
| Boltz-2 | 機密データの保持、大規模計算、独自の改良 | 完全無料、高速、自社サーバーで運用可能 | セットアップにIT知識が必要 |
医療現場で「あるタンパク質の変異が構造にどう影響するか見たい」という場合は、まずはColabFoldで十分です。一方で、「このタンパク質に既存の薬剤がはまる可能性を探りたい」という研究的な問いには、AlphaFold3やBoltz-2がその威力を発揮します。
7. 考察:AI構造予測が変える「近未来の医療」
これらのAIツールが医療に与えるインパクトは、単なる「計算の効率化」に留まりません。私が特に注目しているのは、以下の3点です。
- 希少疾患へのアプローチ: 患者数が少なく、製薬企業が投資しにくかった疾患に対しても、AIによる低コストな創薬シミュレーションが道を拓きます。
- 個別化医療の深化: 患者さん個人の持つ遺伝子変異に基づき、その人のタンパク質に最適に結合する薬剤をオーダーメイドで選択・設計できる時代が近づいています。
- 薬剤耐性問題の克服: ウイルスの変異を先回りして予測し、耐性が生じにくい部位を狙った薬剤を設計することが可能になります。
もちろん、AIが導き出すのはあくまで「予測」です。最終的には、私たち人間(医療者・研究者)がその妥当性を判断し、臨床試験を通じて安全性を確かめる必要があります。しかし、AIという強力な「眼鏡」を手に入れたことで、私たちの視界はかつてないほど明瞭になっているのです。
8. まとめ
タンパク質構造予測AIの世界は、AlphaFold2の登場からわずか数年で、AlphaFold3、Chai-1、そしてBoltz-2といった多様な進化を遂げました。
- AlphaFold3で精密な「形」を捉え、
- Boltz-2でその知見を高速かつ自由に広め、
- Chai-1で実務へと橋渡しする。
これらのツールは、もはや一部の計算科学者だけのものではありません。医療に関わる全ての人が、その可能性を知り、活用を検討する価値のある強力な武器です。ファーマAIラボでは、今後もこれらの技術がどのように臨床現場を変えていくのか、最新情報を追い続けていきます。
免責事項
本記事に掲載されている情報は、公開時点の学術的知見および各ツールの仕様に基づいたものです。AIによる予測結果は常に正確であることを保証するものではなく、実際の診断や治療、研究成果を保証するものではありません。本記事の利用により生じた直接的・間接的な損害について、筆者および当ブログは一切の責任を負わないものとします。実際の研究や臨床への応用にあたっては、必ず最新の一次文献を確認し、適切な専門家の指導の下で行ってください。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「AlphaFold時代の構造バイオインフォマティクス実践ガイド〜今日からできる!構造データの基本操作から相互作用の推定、タンパク質デザインまで (実験医学別冊 最強のステップUPシリーズ) 」を見る