1. はじめに:なぜ医薬品の多くは「タンパク質」を狙うのか
医療現場で使用される薬剤の多くは、体内の特定の分子に結合することでその機能を調節し、治療効果を発揮します。この「狙い撃ち」にされる分子を「医薬品ターゲット」と呼びますが、その正体のほとんどはタンパク質です。
タンパク質は、アミノ酸が連なってできた立体的な構造体であり、私たちの体内で酵素、受容体、構造維持など、生命活動のほぼすべてを担っています。そのため、病態に関与する特定のタンパク質を制御することが、最も効率的な治療法となるのです。
本記事では、医薬品ターゲットにおけるタンパク質の割合やその分類、そしてまだ薬が届いていない「未踏の領域」について、最新の知見をステップバイステップで紐解いていきます。
2. ステップ1:統計で見る医薬品ターゲットの現状
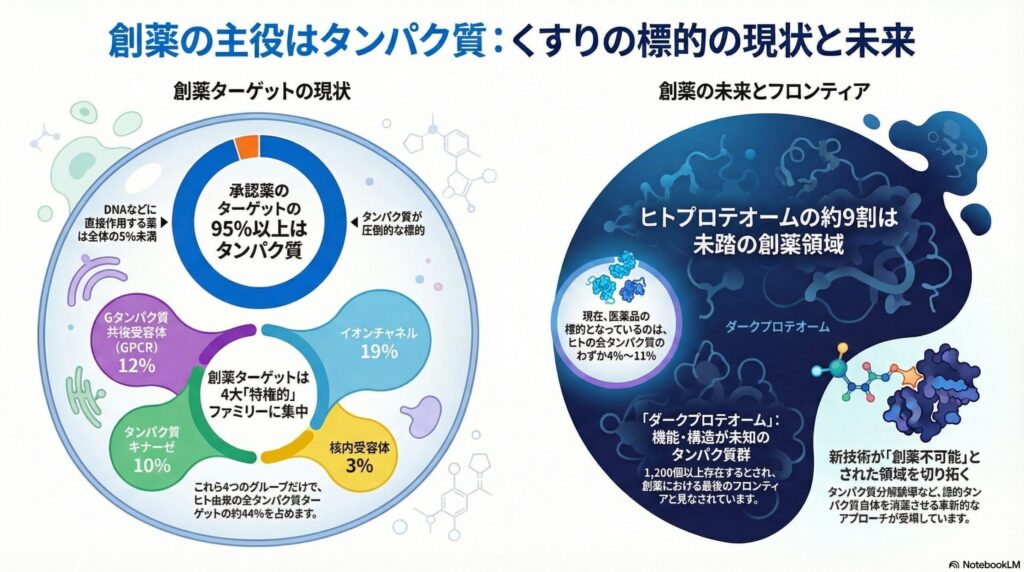
現在の創薬において、タンパク質は他の分子(DNA、RNA、脂質など)を圧倒するシェアを誇っています。最新の研究データによると、FDA(米国食品医薬品局)で承認された薬剤が標的とする分子のうち、実に95%以上がタンパク質であることが分かっています。
具体的には、1,500種類以上の承認薬が作用する約890個のターゲット分子のうち、850個以上がタンパク質です。これにはヒト由来のタンパク質だけでなく、抗生物質などが標的とする病原体(細菌やウイルス)由来のタンパク質も含まれています。
非タンパク質ターゲット、例えばDNAに直接作用する細胞毒性抗がん剤などは、全体の5%未満に過ぎません。この圧倒的な偏りは、タンパク質が「薬と結合しやすいポケット(結合部位)」を持ちやすい構造であることを示唆しています。
3. ステップ2:創薬における「特権的」な4大タンパク質ファミリー
すべてのタンパク質が均等にターゲットになるわけではありません。創薬の世界には、薬が効きやすく、歴史的にも研究が進んでいる「特権的なファミリー」が存在します。以下の4つのグループだけで、ヒト由来のターゲットの約44%を占めています。
| ファミリー名 | 全ターゲットに占める割合 | 主な役割と特徴 |
| Gタンパク質共役受容体(GPCR) | 12% | 細胞外の信号を細胞内に伝えるスイッチ。薬のターゲットとして最も有名です。 |
| イオンチャネル | 19% | 細胞膜でイオンを通す門。神経や筋肉の興奮伝達に深く関わります。 |
| タンパク質キナーゼ | 10% | 他のタンパク質をリン酸化(活性化)する酵素。がん治療薬の主要ターゲットです。 |
| 核内受容体 | 3% | 細胞核内で遺伝子の働きを制御する受容体。ステロイドホルモンなどが結合します。 |
これらのファミリーは、低分子医薬品がターゲットの深部に入り込みやすいため、長年創薬の中心地となってきました。
4. ステップ3:ヒトプロテオームの全貌と「創薬の伸び代」
「プロテオーム」とは、ある生物が持つすべてのタンパク質のセットを指す言葉です。ヒトのゲノムには約2万個のタンパク質を作る設計図がありますが、現在私たちが薬のターゲットとして利用できているのは、そのうちのわずか4%〜11%(約700〜900個)に過ぎません。
これは、残りの約9割のタンパク質が、これまでの技術では「薬を結合させることが難しい」と判断されてきたためです。これを「創薬不可能(Undruggable)」な領域と呼ぶこともあります。
しかし、これは裏を返せば、まだ私たちが手をつけていない治療の可能性が膨大に残されていることを意味します。現在の4〜11%というカバー率を、2035年までに全プロテオームへ拡大しようとする「Target 2035」という国際的なプロジェクトも進行しています。
5. ステップ4:体内のタンパク質はどう分類されるのか?
ヒトの体内にある数万種類のタンパク質は、その機能や場所によって大きく5つに分類できます。これらを理解することは、薬の副作用や作用機序を理解する上でも非常に重要です。
- 酵素類(Enzymes): 化学反応を助ける触媒です。キナーゼやプロテアーゼ(タンパク質分解酵素)などが含まれます。
- 受容体(Receptors): 信号を受け取るアンテナです。前述のGPCRなどが代表例で、細胞の応答を決定します。
- 構造タンパク質(Structural Proteins): 細胞の形を作る骨組みです。コラーゲンやアクチンなどがこれに当たります。
- 輸送タンパク質(Transport Proteins): 物質を運ぶ運び屋です。血液中のヘモグロビンや、細胞膜のトランスポーターがあります。
- 防御タンパク質(Defense Proteins): 体を守る武器です。免疫グロブリン(抗体)がその代表です。
これらのタンパク質は全身に均一にあるわけではなく、肝臓には代謝酵素、脳には受容体というように、組織ごとに特異的な発現パターンを持っています。
6. ステップ5:未解明の領域「ダークプロテオーム」の正体
最新の研究でも、依然として機能や構造が全く分かっていない「ミッシングタンパク質(未発見タンパク質)」が1,200個以上存在するとされています。これらは「ダークプロテオーム」と呼ばれ、創薬における最後のフロンティアです。
従来の創薬は、タンパク質の表面にある「鍵穴(ポケット)」に「鍵(薬)」を入れる手法でした。しかし、ダークプロテオームに属するタンパク質は、決まった形を持たないものや、他のタンパク質と複雑に絡み合っているものが多く、従来の「鍵穴」が見当たりません。
近年のAI(人工知能)技術、例えばDeepMind社のAlphaFoldなどは、これらの未知のタンパク質の立体構造を予測することで、創薬のスピードを劇的に加速させています。
7. ステップ6:次世代創薬が拓く新しいターゲット
これからの創薬は、単一のタンパク質を狙うだけではなく、より複雑な相互作用を標的にする方向へと進化しています。特に注目されているのが、以下の2つのアプローチです。
- タンパク質-タンパク質相互作用(PPI): タンパク質同士が握手をするように結合する部位を狙います。従来は面積が広く平坦なため難しいとされてきましたが、新しい設計技術で攻略が進んでいます。
- タンパク質分解誘導(Targeted Protein Degradation): 薬でタンパク質の機能を止めるのではなく、細胞内の掃除機能を利用して、標的タンパク質そのものを分解・消失させる画期的な技術です。
これらの技術により、これまで「薬にならない」と諦めていたタンパク質が、次々と有力な治療ターゲットへと変貌を遂げつつあります。
8. まとめ:タンパク質研究がもたらす医療の変革
医薬品ターゲットの大部分を占めるタンパク質の理解は、現代医療において欠かせない知識です。現在、私たちが利用しているターゲットは全体の氷山の一角に過ぎませんが、テクノロジーの進化によってその全貌が解明されようとしています。
医療従事者の皆様にとって、これらの基礎知識をアップデートし続けることは、今後登場する革新的な新薬(バイオ医薬品や核酸医薬品、近接誘導製剤など)の作用機序を深く理解するための助けとなるでしょう。
ファーマAIラボでは、今後も最新の創薬科学とテクノロジーの交差点から、有益な情報をお届けしてまいります。
免責事項
本記事の内容は、公開時点の学術的知見に基づき作成されていますが、医療情報の正確性や完全性を保証するものではありません。実際の診断や治療、薬剤の使用にあたっては、必ず最新の添付文書や診療ガイドラインを確認し、専門医の指示に従ってください。本記事の利用により生じたいかなる損害についても、当ラボおよび著者は一切の責任を負わないものとします。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「プロテオーム解析: 理論と方法」を見る