1. はじめに AI創薬における「可視化」の重要性
AI創薬の現場では、コンピュータが数百万もの化合物の中から、ターゲットとなるタンパク質に結合しそうなものを選び出します。これを「バーチャルスクリーニング」と呼びますが、最終的にその結果を採用するかどうかは、人間の研究者が判断します。
このとき、分子がどのように結合しているかを「目で見える形」にするのがPyMOL(パイモル)というソフトウェアです。タンパク質の複雑な構造を3Dグラフィックスで描き出し、リガンド(薬の候補分子)がポケットに収まる様子を鮮明に映し出します。
しかし、ただ眺めるだけでは不十分です。どの原子とどの原子が引き合っているのか、その「化学的な根拠」を客観的に示す必要があります。そこで登場するのが、画像でも紹介されているPLIPという技術なのです。
2. PLIPが解明する「分子間相互作用」の4つの鍵
分子同士が結合するには、いくつかの「引き合う力」が必要です。PLIP(Protein-Ligand Interaction Profiler)は、これらを自動で検出し、分類してくれます。代表的な4つの相互作用を見てみましょう。
- 水素結合 (Hydrogen Bonds)最も一般的で強力な結合の一つです。水分子の構成要素である水素原子を介して、分子同士が手をつなぐようなイメージです。薬の向きを固定するガイドの役割を果たします。
- 塩橋 (Salt Bridges)プラスとマイナスの電荷が引き合う強力な力です。磁石のように強く引き合うため、薬をターゲット部位にがっちりと固定するのに役立ちます。
- 疎水性相互作用 (Hydrophobic Interactions)「油は油と混ざり合う」性質を利用した結合です。水に馴染みにくい部分同士が密着することで、結合をより安定なものにします。
- $\pi$-スタッキング ($\pi$-Stacking)芳香環と呼ばれる平らな構造同士が、パンケーキのように重なり合う結合です。分子の構造を特定の形に保つのに重要な役割を担います。
これらの相互作用を、PLIPは専門知識がなくても理解できる形へとデジタル化してくれるのです。
3. PyMOLとPLIPを組み合わせた実践的ワークフロー
では、実際にどのようにAI創薬が進められるのでしょうか。具体的なステップを紹介します。
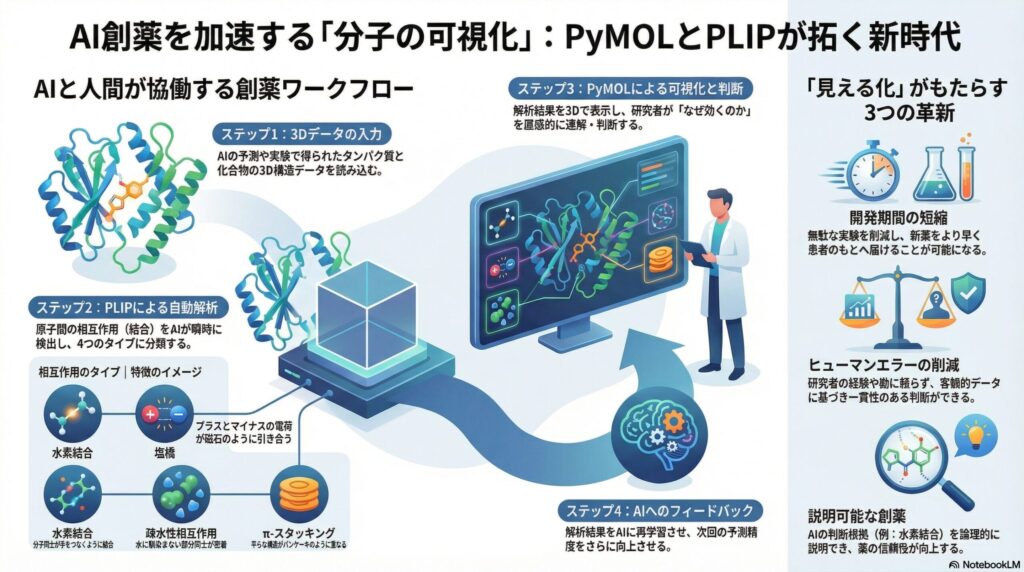
ステップ1:3Dデータの入力
まず、タンパク質と化合物の3D構造データを読み込みます。これは、X線結晶構造解析などで得られた実データや、AIが予測したシミュレーションデータです。
ステップ2:自動検出と分類
ここでPLIPの出番です。幾何学的な基準に基づき、原子間の距離や角度をスキャンします。人間が定規で測るような作業を、AIが瞬時に行い、前述した結合タイプごとに自動分類します。
ステップ3:PyMOLによる可視化と判断
PLIPが検出した情報をPyMOL上に反映させます。水素結合を点線で表示したり、重要な残基(タンパク質の一部)を強調したりすることで、研究者は「この化合物はここが効いているから、もう少し改良できそうだ」と判断できます。
ステップ4:AIへのフィードバック
解析結果は再びデジタルデータとしてAIに学習させます。「この形状の結合は安定しやすい」という知見が蓄積されることで、次回のAI予測の精度がさらに向上していくのです。
4. 医療関係者が知っておくべき「AI創薬のメリット」
この技術の導入により、創薬の現場には劇的な変化が起きています。医療関係者の皆様にとっても、以下の3つのポイントは非常に重要です。
- ヒューマンエラーの削減従来は研究者の経験と勘に頼っていた相互作用の判断を、PLIPのようなツールが自動化・客観化します。これにより、一貫性のある高品質な解析結果が得られるようになりました。
- 開発期間の短縮「見て判断」するプロセスが高速化されることで、無駄な実験を減らすことができます。これは、新しい治療薬をより早く患者さんのもとへ届けることにつながります。
- 説明可能な創薬「AIが選んだから」というブラックボックスではなく、「このアミノ酸と水素結合しているから有効である」という論理的な説明が可能になります。これは、薬の安全性や有効性を評価する上で欠かせない視点です。
5. 次世代の可視化技術:ARとリアルタイム解析
今後の展望として、可視化技術はさらに進化していきます。例えば、VR(仮想現実)やAR(拡張現実)を用いて、研究者がタンパク質の中に潜り込み、手で化合物を操作しながら設計する技術も開発されています。
また、最新のPyMOLプラグインでは、量子化学計算をリアルタイムで行い、電子の動きまで可視化できるようになりつつあります。AIが予測し、人間がその意図を深く理解する。この「協調」こそが、これからの新薬開発のスタンダードになるでしょう。
AI創薬は、単なるコンピュータの計算結果ではありません。PyMOLやPLIPといった「目」と「知覚」を与えるツールがあるからこそ、私たちは分子の世界を正しく理解し、次の一歩を踏み出せるのです。
免責事項
本記事に記載された情報は、一般的な情報提供を目的としており、特定の医療行為や薬剤の使用を推奨するものではありません。情報の正確性については細心の注意を払っておりますが、最新の科学的知見に基づき内容が変更される可能性があります。本記事の利用により生じたいかなる損害についても、当方は一切の責任は負わないものとします。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「AIが変える製薬の未来 (AIが変えるシリーズ)」を見る