1.はじめに
2024年、Google DeepMind社のDemis Hassabis氏とJohn Jumper氏らがノーベル化学賞を受賞したことは、記憶に新しいことでしょう。その授賞理由は「タンパク質の構造予測」に対する貢献でした。そして、その中核技術である「AlphaFold」は、2024年5月に最新版「AlphaFold3」へと進化を遂げました。
医療現場や基礎研究の第一線にいる皆様にとって、この技術は単なるニュースではありません。これは、疾患メカニズムの解明から新規薬剤の設計に至るまで、医学・薬学の「時間軸」と「解像度」を劇的に変えるツールです。
本記事では、AlphaFold3が従来の技術と何が違うのか、そして無料公開された「AlphaFold Server」をどのように研究や臨床の理解に役立てるべきか、専門家の視点で分かりやすく解説します。
2.AlphaFold3の衝撃:タンパク質単体から「生命の相互作用」へ
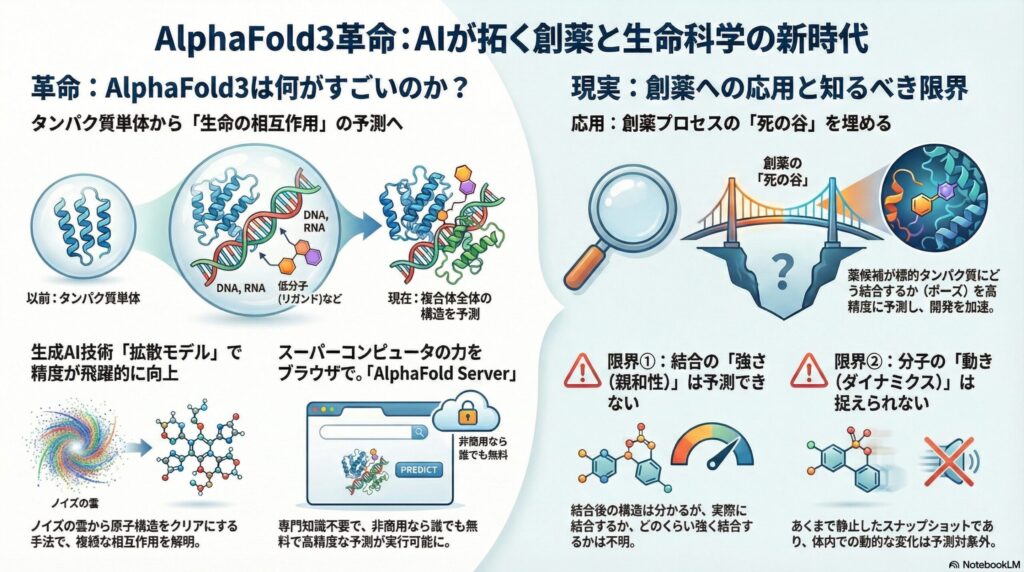
これまでのAlphaFold2は、あくまで「タンパク質単体(あるいはタンパク質同士)」の構造を予測するものでした。しかし、生体内の現象はタンパク質だけで完結しません。DNAが読み出され、RNAが翻訳され、低分子(リガンド)やイオンが結合して初めて機能します。AlphaFold3の最大の革新は、これら「生体分子の複合体」全体を予測対象にしたことにあります。
2.1. 拡散モデル(Diffusion Model)の導入
AlphaFold3の精度の肝となるのが、生成AI(画像生成AIなど)で用いられる「拡散モデル」の導入です。 従来のAIが、アミノ酸の配列から幾何学的に構造を組み立てようとしていたのに対し、拡散モデルは「ノイズのかかった雲のような原子の分布」から、徐々にノイズを除去して鮮明な分子構造を浮かび上がらせる手法を取ります。これにより、タンパク質だけでなく、DNA、RNA、そしてリガンド(薬剤候補化合物)が複雑に絡み合った構造を、統一的な枠組みで予測することが可能になりました。
2.2. 創薬ターゲットの拡大
これにより、従来は構造解析が困難だった「転写因子とDNAの複合体」や「抗体と抗原の相互作用」、さらには「翻訳後修飾(リン酸化や糖鎖など)」を含んだ状態での予測が可能になりました。 特に、薬剤の標的となるリガンド結合部位(ポケット)の形状予測精度が向上したことは、SBDD(構造ベース創薬)において、実験的な結晶構造解析を待たずにドッキングシミュレーションを行える可能性を示唆しています。
3.AlphaFold Serverの登場:スーパーコンピュータをブラウザの中に
AlphaFold3のもう一つの革命は、そのアクセシビリティです。かつて、高精度の構造予測を行うには、ハイスペックなGPUサーバーや高度なバイオインフォマティクスの知識(コマンドライン操作など)が必須でした。しかし、Google DeepMindは「AlphaFold Server」というWebプラットフォームを通じて、この障壁を取り払いました。
3.1. 誰でも使える「民主化」されたツール
AlphaFold Serverは、Googleアカウントがあれば、非商用利用に限り無料で利用可能です(2025年現在)。操作は驚くほどシンプルです。
- 入力: 解析したいタンパク質のアミノ酸配列、DNA配列、あるいは低分子のSMILES記法(化学構造を表す文字列)を入力します。
- 設定: それらが1つの複合体として相互作用するかどうかを指定します。
- 実行: ボタンを押して数分待つだけです。
3.2. 医療関係者にとってのメリット
例えば、希少疾患の患者さんで見つかった「意義不明の変異(VUS)」が、タンパク質の構造やリガンド結合能にどのような影響を与えるかを、その場でシミュレーションすることが可能です。 また、薬剤師や薬理学の研究者であれば、既存薬が標的タンパク質のどの部位に結合し、なぜ特定の変異に対して耐性を持つのかを、3次元構造として視覚的に確認することができます。これは、メカニズムの教育や患者説明の資料作成(非商用範囲内)においても強力な武器となります。
4.AI創薬における実践的応用と精度の向上
AlphaFold3は、創薬プロセスにおける「死の谷」を埋める架け橋として期待されています。具体的には、以下の分野で顕著な成果を上げています。
4.1. ポーズ予測の精度向上
創薬において最も重要なのは、薬(リガンド)が標的タンパク質のポケットに「どのような向き(ポーズ)」で結合するかを知ることです。 AlphaFold3は、PoseBustersというベンチマークにおいて、従来の物理化学的なドッキング計算ソフトを凌駕する精度を叩き出しました。しかも、リガンドの結合に伴うタンパク質側の微細な構造変化(側鎖の動きなど)もある程度予測に反映されます。これにより、ヒット化合物の探索(スクリーニング)の精度が飛躍的に向上します。
4.2. 抗体医薬品設計への応用
抗体医薬品開発では、抗原(エピトープ)と抗体(パラトープ)の結合予測が鍵となります。AlphaFold3はこのタンパク質間相互作用(PPI)の予測精度も高いため、より親和性が高く、特異性の高い抗体配列のデザインに貢献します。 すでに、Googleの姉妹会社であるIsomorphic Labsは、製薬大手(イーライリリーやノバルティス)と提携し、実際の創薬パイプラインにこの技術を組み込み始めています。
5.専門家が知っておくべき「限界」と「注意点」
ここまで利点を強調してきましたが、医療の専門家として、この技術の「限界」も正しく理解しておく必要があります。AlphaFold3は魔法の杖ではありません。
5.1. 結合親和性(Affinity)は予測できない
ここが最大の誤解ポイントです。AlphaFold3は「結合した状態の構造」を高精度に予測しますが、「どのくらい強く結合するか(結合定数 Kd値など)」や「そもそも本当に結合するのか」を判定する能力は限定的です。 つまり、全く結合しないはずのランダムな分子を入力しても、AIは「無理やり結合させたもっともらしい構造」を出力してしまう可能性があります(ハルシネーション)。結合の強さを知るには、依然として実験や、FEP(自由エネルギー摂動)法などの物理計算が必要です。
5.2. ダイナミクスの欠如
タンパク質は水溶液中で絶えず揺れ動いています。AlphaFold3が出力するのは、あくまで「ある一つの安定状態(スナップショット)」に過ぎません。 酵素反応の遷移状態や、大きな構造変化(アロステリック効果など)を伴う動きを完全に予測するには、分子動力学(MD)シミュレーションとの併用が不可欠です。また、天然変性領域(IDR)のような定まった構造を持たない部分の予測信頼度は低くなります。
6.結論:AIと実験科学の融合が拓く未来
AlphaFold3とAlphaFold Serverの登場は、生物学における「Googleマップ」を手に入れたようなものです。かつては手書きの地図(実験による構造決定)を作るのに何年もかかりましたが、今では目的地(目的の分子)を入力すれば、瞬時に詳細な地形(3D構造)が表示されます。
しかし、その地図が「現在の交通状況(ダイナミクス)」や「道の歩きやすさ(結合親和性)」まで完全に反映しているわけではありません。だからこそ、私たち人間がその情報を解釈し、実験(ウェット)で検証するというプロセスが、これまで以上に重要になります。
6.1. 医療従事者・研究者の皆様へ
まずは、AlphaFold Serverにアクセスし、ご自身の専門領域のタンパク質を入力してみてください。教科書の2次元の図が、3次元のリアルな分子として動き出す感動は、新しいインスピレーションを与えてくれるはずです。 AIは私たちの仕事を奪うものではなく、私たちがより創造的で、より本質的な「生命の謎」に挑むための最強のパートナーとなるでしょう。
免責事項
本記事は、医療関係者および研究者への情報提供を目的としており、臨床における診断・治療の勧告や医学的アドバイスを意図したものではありません。内容の正確性には万全を期していますが、急速に進展するAI技術の性質上、情報の完全性や最新性を保証するものではありません。本記事の情報、または紹介したツールの利用によって生じたいかなる損害や不利益についても、当ブログおよび著者は一切の責任を負いません。 実臨床や研究での判断は、必ず公的ガイドラインや専門家の最終的な判断に従ってください。
本記事は生成AIを活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「AlphaFold時代の構造バイオインフォマティクス実践ガイド〜今日からできる!構造データの基本操作から相互作用の推定、タンパク質デザインまで 」を見る