1.はじめに:なぜ今、医療現場で「分子の動き」を知る必要があるのか
現代の創薬研究において、ターゲットとなるタンパク質と薬候補物質(リガンド)が「どのように結合し、どのように動くか」を理解することは、治療薬の有効性や安全性を予測する上で欠かせません。
従来の実験手法だけでは捉えきれない、ナノ秒・マイクロ秒単位の微細な挙動を可視化するのが「分子動力学(MD)シミュレーション」です。本記事では、世界で最も利用されているシミュレーションソフトの一つである「GROMACS」の最新動向と、その具体的な活用方法について、医療関係者の皆様に向けて分かりやすく解説します。
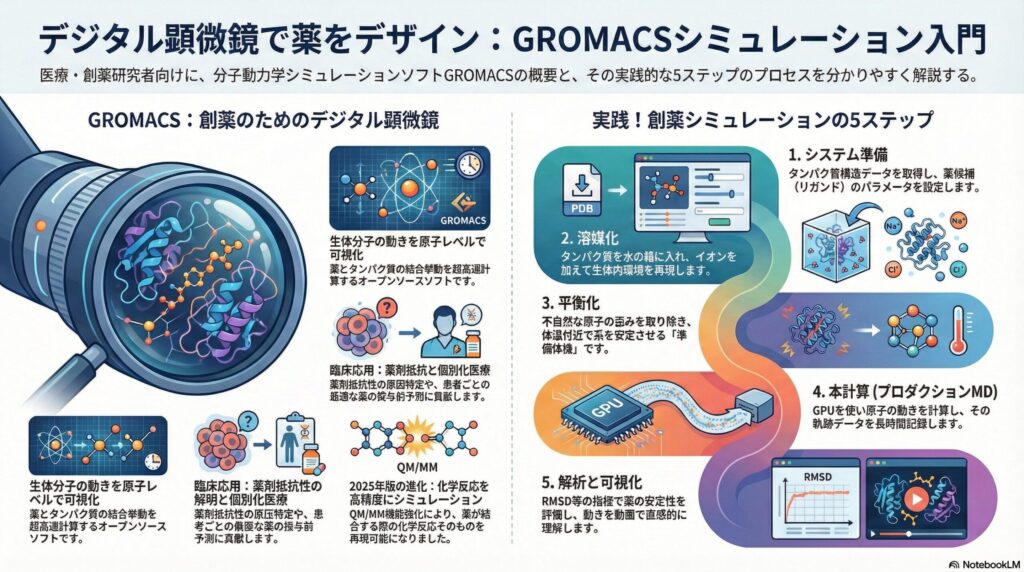
2.GROMACSとは?:生体分子の挙動を解き明かす「デジタル顕微鏡」
GROMACS(グロマクス)は、オランダのフローニンゲン大学で開発された、オープンソースの分子動力学シミュレーションソフトです。その最大の特徴は、計算速度が極めて速く、タンパク質や脂質、核酸といった生体分子の解析に特化している点にあります。
医療・創薬の分野では、新しい薬が病気の原因タンパク質にどれくらい強く結合し続けるか、あるいは結合によってタンパク質の形がどう変わるかをシミュレーションするために、世界中の研究機関や製薬企業で標準的に採用されています。
3.2025年の劇的進化:GROMACS 2025がもたらす新機能のインパクト
2025年2月にリリースされた最新版「GROMACS 2025」では、創薬の精度を劇的に向上させる機能が追加されました。特筆すべきは、量子化学計算コード「CP2K」との連携による「QM/MMインターフェース」の強化です。
「QM/MM」とは、薬が反応する中心部を量子力学(QM)で、周囲の広大な分子を分子力学(MM)で計算する手法です。これにより、これまでは困難だった「結合時の化学反応そのもの」を、より現実的な計算コストで、かつ高精度にシミュレーションすることが可能になりました。
4.実践!リガンド-タンパク質シミュレーションの5ステップ
ここからは、実際にGROMACSを用いてシミュレーションを行う際の流れを、ステップ・バイ・ステップで見ていきましょう。専門的なコマンドの背後にある「目的」を理解することが、データ解釈の第一歩となります。
ステップ1:システムの準備と座標データの取得
まずは、タンパク質とリガンドの「形」を定義します。多くの場合、タンパク質構造データバンク(PDB)から実験データを取得します。ここで重要なのは、リガンドのパラメータ(力場)の設定です。
タンパク質は定型的な構造ですが、リガンドは千差万別です。そのため、「LigParGen」などのツールを用いて、リガンド特有の電荷や結合角を正しく定義する必要があります。この準備の正確さが、シミュレーション全体の信頼性を左右すると言っても過言ではありません。
ステップ2:シミュレーションボックスの設定と溶媒化
生体内の環境を再現するため、タンパク質を仮想の「箱」に入れ、そこを水分子で満たします。これを「溶媒化」と呼びます。単に水を入れるだけでなく、体内のイオン濃度を再現するために塩(ナトリウムイオンや塩化物イオン)を加え、システム全体の電荷を中和します。
このプロセスにより、試験管の中や細胞内のような、ゆらぎのある環境をコンピューター内に作り出すことができます。GROMACS 2025では、この溶媒の配置計算もさらに高速化されています。
ステップ3:エネルギー最小化と平衡化
準備したばかりのシステムは、原子同士が近すぎたり、不自然な歪みがあったりします。そのままシミュレーションを始めると、系が爆発するように崩れてしまいます。そのため、まずは「エネルギー最小化」を行い、最も安定な配置を探ります。
その後、温度や圧力を一定に保つ「平衡化」を行います。これはいわば、準備体操のようなものです。系が310K(体温付近)で安定して動くようになるまで、じっくりと時間をかけて馴染ませていくプロセスです。
ステップ4:プロダクションMD(本計算)の実行
いよいよ、実際の挙動を計算する「本計算」です。ニュートンの運動方程式を解き続け、原子一つひとつの位置の変化を記録していきます。近年のGPU(画像処理装置)の進化により、かつては数ヶ月かかった計算が、今では数日で完了するようになりました。
最新のGROMACS 2025では、複数のGPUを効率よく並列稼働させる機能が最適化されており、より長時間の、あるいはより大規模なタンパク質複合体のシミュレーションが可能になっています。
ステップ5:データの解析と可視化
計算が終わると、膨大な「軌跡データ」が得られます。これを解析して、薬の安定性を評価します。主要な指標には、構造のズレを示す「RMSD」や、各部位の動きやすさを示す「RMSF」があります。
これらの数値をグラフ化することで、「この薬を結合させるとタンパク質の特定の部位が固まり、機能が抑制される」といった医学的な考察が可能になります。目で見える動画(アニメーション)として可視化することも、直感的な理解を助ける重要なステップです。
5.解析結果をどう読むか?:医療・創薬における重要指標の解説
シミュレーション結果を評価する際、特によく使われる指標について、平易な言葉で解説します。これらを理解することで、論文や研究報告の深掘りができるようになります。
- RMSD(二乗平均平方根偏差): 最初の形からどれくらい変化したかを示す指標です。この値が一定で安定していれば、シミュレーションがうまく収束している証拠です。
- RMSF(二乗平均平方根ゆらぎ): 残基(アミノ酸)ごとの「ふるえ」を示します。薬が結合した場所のRMSFが下がっていれば、そこがしっかりと固定されていることを意味します。
- 結合自由エネルギー: 薬がどれくらい強く結合しているかを数値化したものです。この値が負に大きいほど、強力な結合が期待できます。
6.臨床への応用:薬剤抵抗性と個別化医療への展望
GROMACSを用いた研究は、単なる基礎研究に留まりません。例えば、がん治療における「薬剤抵抗性」のメカニズム解明に大きく貢献しています。タンパク質に特定の変異が入った際、既存の薬の結合様式がどう変わるかをシミュレーションすることで、抵抗性の原因を特定できます。
また、将来的には患者個人の遺伝子変異に基づいた「個別化シミュレーション」も期待されています。特定の変異を持つ患者さんに、どの分子構造の薬が最も適しているかを、投与前にインシリコ(計算機上)で予測する時代の足音が聞こえています。
7.未来の展望:AIと量子計算の融合がもたらすもの
2026年現在、GROMACSはさらなる進化を続けています。機械学習(AI)と統合することで、膨大な計算結果から「結合に重要な一瞬」を自動で抽出する技術が実用化されつつあります。
また、量子コンピューティングの発展に伴い、ハイブリッドな計算手法も研究されています。GROMACS 2025で強化されたインターフェースは、まさにその未来への架け橋と言えるでしょう。分子レベルの深い理解は、より副作用が少なく、効果の高い革新的新薬の誕生を加速させます。
8.まとめ:GROMACSを研究の強力なパートナーに
GROMACSを用いた分子動力学シミュレーションは、もはや専門家だけのツールではありません。使いやすいインターフェースの整備や、クラウド計算環境の普及により、多くの医療従事者がその恩恵を受けられるようになっています。
最新のGROMACS 2025を活用することで、私たちは生命の神秘を原子レベルで紐解き、より良い治療の実現に近づくことができます。この記事が、皆様の新たな研究や臨床へのインスピレーションとなれば幸いです。
免責事項
本記事に記載された情報は、公開時点での技術的・学術的知見に基づいたものであり、その正確性や将来の結果を保証するものではありません。ソフトウェアの使用や研究への適用に際しては、必ず公式ドキュメントを確認し、個別の状況に応じた判断を行ってください。本記事の内容を利用したことにより生じたいかなる損害についても、当方およびファーマAIラボは責任を負わないものとします。
本記事は生成AI (Gemini) を活用して作成しています。内容については十分に精査しておりますが、誤りが含まれる可能性があります。お気づきの点がございましたら、コメントにてご指摘いただけますと幸いです。
Amazonでこの関連書籍「大規模データで困ったときに、まず図を描くことからはじめる生命科学データ解析〜解析のゴールドスタンダードを学び、生成AIとの対話でPython・Rを使いこなす (実験医学別冊)」を見る